癌癥疫苗有望成為具有變革意義的個性化免疫療法
我們知道,免疫療法有免疫細胞培養增強后回輸,有免疫檢查點抑制劑的使用,還有癌癥疫苗等等方法,而且還在不斷的研究和探索中。最近發表在《Science Translational Medicine》上的一項臨床試驗,個性化癌癥疫苗已讓一名晚期卵巢癌5年無癌,這也讓我們看到了癌癥疫苗的無限潛力。
隨著基因組學、數據科學、以及癌癥免疫療法的進步,現在我們已經能快速地在基因組里尋找到突變,并合理地選擇出適用于疫苗開發的靶點,按需生產出針對特定患者的個體化疫苗。在人體中的臨床試驗也表明,此類癌癥疫苗安全有效,能針對個體腫瘤突變產生免疫應答。
癌癥疫苗的發展史
早在100多年前,人們就意識到體細胞的突變可以帶來新的免疫原性——基因突變會影響蛋白序列,蛋白序列的改變則會帶來新的抗原表位。盡管出現在人體內部,免疫系統依舊會把這些新表位視為“外來人口”,對其發動攻擊。這一理念簡單易懂,但癌癥疫苗一直沒有得到有效的開發。背后的原因,則是因為我們不知道如何去靶向特定的癌癥及其抗原。
半個多世紀后,通過大量實驗,我們從機理上對癌癥疫苗的理解又有了加深。1950年代,人們發現小鼠對同一類型的癌癥細胞會產生免疫力;1970年代,人們發現腫瘤里獲取的T細胞能有效地識別腫瘤細胞系;1980年代,分子克隆技術的引入讓我們對腫瘤抗原的了解獲得了進一步的提高。
雖然在過去的幾十年里,關于癌癥疫苗的科學有著飛速發展,但科研人員們卻面臨著一大瓶頸——許多突變往往具有“患者特異性”。也就是說,在一名患者身上出現的大量突變,可能壓根不在另一名患者身上出現。為此,過去的癌癥疫苗往往針對“共通”的突變進行研發,但效果不如人意。
早期臨床試驗的進展
隨著下一代測序(NGS)等技術的普及,了解患者的特異性突變已經不再是個難題。然而初步研究卻發現,大約只有1%左右的突變會帶來自發的免疫反應。如果這一比例具有代表性,那對于癌癥疫苗的開發而言并不算什么好消息。
幸運的是,進一步的研究表明,實際上能引起免疫應答的突變比例要高得多,大部分新表位都能被CD4+ 輔助性T細胞所識別。在小鼠模型中,針對這些新表位開發出的疫苗能有效控制小鼠的晚期腫瘤。
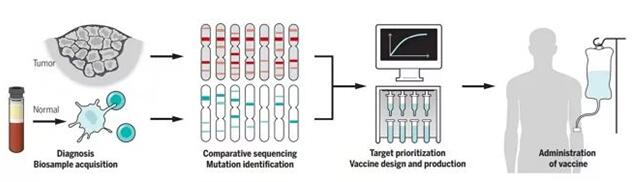
▲個體化癌癥疫苗的開發(圖片來源:K. SUTLIFF/SCIENCE)
但從小鼠到人類的轉化并不是一項簡單的工作。為了在人體內復制成功,我們需要經歷鑒別突變、預測表位、設計疫苗、并生產疫苗這一系列復雜的工作。在3項治療惡性黑色素瘤的早期臨床試驗中,癌癥疫苗在人體內的可行性得到了驗證。無論是使用代表腫瘤突變的多肽,還是編碼腫瘤突變的RNA,這些疫苗均取得了可喜的進展,總體免疫原性率達60%。而接受疫苗的每名患者,也都對其腫瘤突變產生了強有力的T細胞反應。
總體來看,這些小型的早期臨床試驗證明了癌癥疫苗的潛力,也為進一步的研發指明了方向。
新抗原表位的預測與選擇
個體化癌癥疫苗的關鍵之一,在于精準地找到腫瘤的“突變組”(mutanome),并由此選擇能帶來最優免疫反應的那些突變。要做到這一點,首先我們需要發現腫瘤患者中的突變。目前,我們常用的手段是利用NGS技術,比較腫瘤樣本與健康組織外顯子組中的異同。但這樣的做法可能有幾個局限,其一是這些腫瘤樣本往往來自患者的活檢,而活檢獲得的小塊腫瘤可能不具有代表性;其二是目前的分析算法僅能確保單核苷酸變異(SNV)和插入/刪除突變(indels)的準確性,但還無法準確體現出表觀遺傳學、轉錄、翻譯、翻譯后修飾等環節為癌癥新表位帶來的影響。
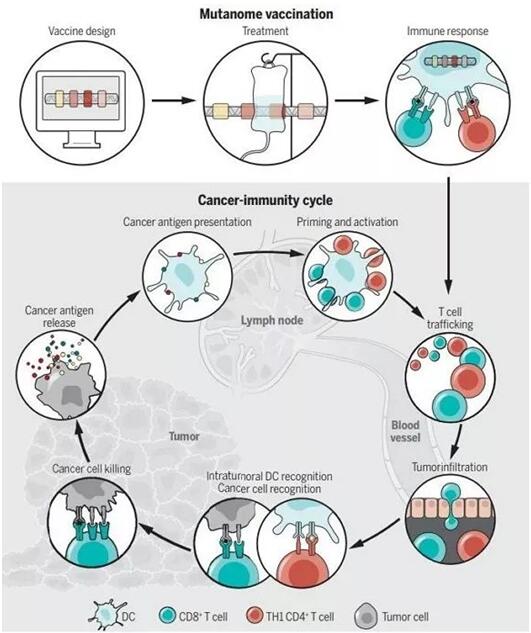
▲新抗原在癌癥免疫中的作用(圖片來源:K. SUTLIFF/SCIENCE)
找到腫瘤突變后,我們還需要從中做出選擇,挑選出最適合開發成疫苗的突變類型。限于成本與技術,我們無法將所有的突變都置入產品之中,而我們也知道,只有部分突變序列足以讓效應T細胞做出回應。因此,如何在這些限制之下,挑選出最具有免疫原性的突變,就成了癌癥疫苗開發的一大關鍵。
目前,我們對于如何挑選這些突變用于后續開發,還沒有一個放之四海皆準的共識。但研究人員們已經總結出來了幾個行之有效的原則,譬如突變基因在腫瘤里的表達量,抑或是突變產生“可呈遞”表位的能力。此外,經驗還告訴我們,如果特定的突變在異質性腫瘤的多個克隆里都普遍具有表達,那么該突變“成疫苗”的潛力可能也更高。
個性化疫苗的制造與臨床應用
在臨床應用上,個體化疫苗所遇到最大的挑戰之一,便是如何快速地制造這些疫苗,并及時地送到每一名患者身邊。目前來看,個體化癌癥疫苗的種類繁多,類型包括長多肽、RNA、DNA質粒、病毒載體、改造細菌、以及載有抗原的樹突狀細胞。根據類型不同,癌癥疫苗的制造周期也有所區別。從臨床試驗中獲得的數據看,無論是采取多肽還是RNA類型,從發現突變到疫苗開發,再到疫苗施用,這一過程需要3-4個月的時間。因此患者在等待時,不得不先接受其他療法的治療。將來,研究人員期望將這一時間縮短到一個月。

▲不同類型的癌癥疫苗(圖片來源:《科學》)
個體化疫苗在臨床應用上的另一個挑戰是確定最佳的治療策略。對于那些免疫系統尚未得到抑制的患者,癌癥疫苗有望發揮奇效。而對于腫瘤具有大量突變的患者,我們或許就應考慮癌癥疫苗+免疫檢查點抑制劑的組合。這是因為癌癥疫苗可以將“冷腫瘤”變成“熱腫瘤”,上調PD-L1在腫瘤微環境里的水平,抗PD-1/PD-L1的免疫檢查點抑制劑也因此有了用武之地。目前,新抗原表位疫苗與PD-1/PD-L1、CTLA4、LAG-3、TIM-3、以及TGF- β的組合也正在多項臨床試驗中進行評估。
個性化免疫療法的未來
在《科學》雜志的這篇綜述中,作者UgurSahin博士與ÖzlemTüreci博士指出在目前的語境下,“個性化治療”往往是“患者分層”的同義詞。根據患者的生物標志物進行分組并展開特定的治療固然是一大進步,也取得了良好的效果,但從狹義上看,這種治療理念還沒有做到真正的“個體化”。而且我們也不能忘記,許多癌癥患者并沒有可用來分組的生物標志物,他們同樣需要行之有效的療法。在這一點上,癌癥疫苗可能帶來突破。
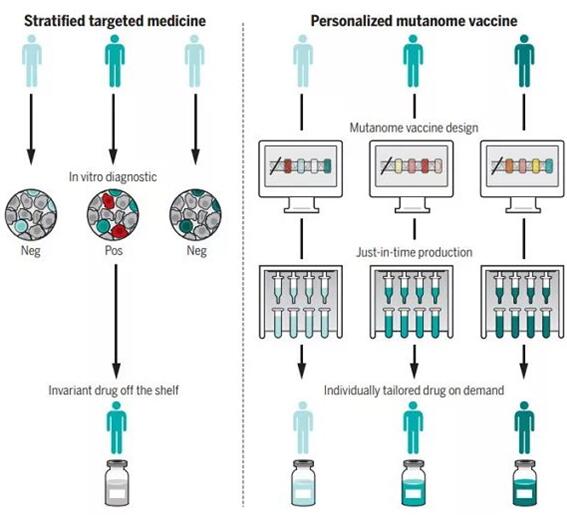
▲癌癥疫苗代表了一類極具潛力的個體化療法(圖片來源:K. SUTLIFF/SCIENCE)
我們也要承認,盡管癌癥疫苗突破了關鍵的瓶頸,并已順利進入臨床試驗,但前方的道路依舊漫長。為了讓這一創新療法得到普及,我們還需要優化臨床設計、減少生產實踐、提高量產規模、確保患者可及。
隨著我們對癌癥生物學的了解越來越深,隨著新抗原表位預測算法的推陳出新(包括機器學習算法的引入),也隨著生產技術的革新,癌癥疫苗有望真正成為一類變革癌癥治療格局的個體化療法。
-
相關內容
- 癌癥疫苗有望成為具有變革意義的個性化免疫療法
- 日本瀨田診所后藤重則教授解答免疫療法
- DC與NK細胞有助于PD-1免疫治療的成功應答
- 邊緣區B細胞可與樹突狀細胞一樣作為抗原呈遞細胞
- 科學家發現通過培養大量樹突狀細胞可以預防癌癥復發
- 日本國立癌癥中心使用免疫療法預防肝細胞癌術后復發
- 日本專家開展對乳腺癌腫瘤微環境和PD-L1的表達的研究
- 日本專家開展對胃癌微環境與PD-L1、PD-L2抗體的研究
- 免疫療法未來可以把人類細胞轉化成為微型的抗腫瘤藥物工廠
- 肺癌術前使用免疫療法可有效預防復發
- 美國科學家不斷完善T細胞的再生,努力實現免疫細胞治療的突破
- 免疫檢查點LAG-3的配體終于確定了
- 腫瘤免疫療法的最新進展與進步
- T細胞在免疫治療中的地位和作用
- 日本制藥巨頭推進細胞療法的抗腫瘤藥物研發
- 樹突細胞治療在免疫細胞治療中的特殊角色
- 如何利用腫瘤疫苗對抗癌癥
- 新發現:腫瘤細胞利用調節性T細胞逃避免疫防御

